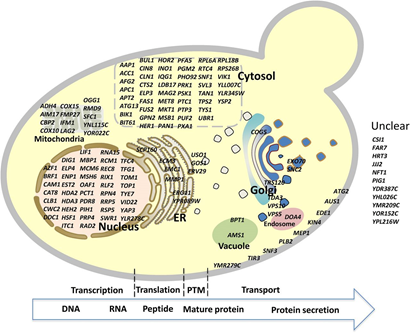
随着人们对于细胞工厂生产的重组蛋白(包括生物制药蛋白和工业酶)的需求日益增长,科学家们不断尝试各种方法来提高宿主细胞生产蛋白能力,例如优化蛋白的转录、翻译以及翻译后修饰、折叠和转运。但由于细胞具有复杂的蛋白分泌机制,而我们对于潜在的机制也缺乏了解,这就限制了我们使用理性代谢工程的方法进行蛋白分泌能力的优化。因此我们需要通过其他的一些方法进行蛋白分泌能力的优化。适应性进化通常可以使细胞在选择压力下积累有益的突变而获得我们想要的表型,但这种方法对于筛选蛋白分泌增强的突变体却过于繁琐。通过引入随机突变也是一种可选择的获得我们想要表型的方法,但通常需要建立一个高通量筛选方法进行有效地筛选。流式细胞仪是一种常用的进行高通量筛选的装置,但因为我们想要筛选的信号应当是分泌到细胞外的,所以流式细胞仪并不能进行有效筛选。
近几年,基于微流控技术的细胞分选方法的出现为我们提供了一项强大的高通量筛选技术。通过产生被油相包裹着的单分散的水液滴,细胞和它的分泌产物会被包裹在分离的液滴中,之后我们就可以进行进一步筛选。目前该技术已被成功运用于酶的定向进化和细胞外产物的检测。
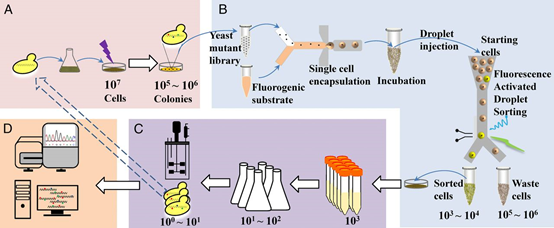
来自瑞典查尔姆斯理工大学的Jens Nielsen等人利用高通量的微流控技术筛选到了一些α-淀粉酶分泌能力增强的酵母,然后通过全基因组测序对有助于增强蛋白分泌的突变位点进行鉴定。实验流程如图1所示。首先通过紫外线照射(λ = 254 nm)在酵母细胞中引入随机突变,产生一个突变体文库,然后将文库细胞与产荧光的α-淀粉酶底物混合,包装成被油包裹的液滴,孵育一段时间后,注射到分选装置中,利用荧光强度的不同筛选出α-淀粉酶高产的突变体。他们之前的实验已证明,α-淀粉酶浓度与荧光强度呈正相关。经过两轮筛选后获得的突变体,通过测定发酵液上清中α-淀粉酶的活性进行复筛。最后,他们将α-淀粉酶分泌能力增强的突变体和原始的母菌均进行全基因组测序,通过基因组比对鉴定到330个可能与蛋白分泌相关的点突变。这些位点或许可用于增强酵母的蛋白分泌能力,而它们功能的解析将有助于我们理解酵母中的蛋白分泌机制。


