
乙醛酸是一种基本有机化工原料,是合成香料、医药、农药等化学品的重要中间体,还广泛应用于高聚物的制备过程中。目前,工业上生产乙醛酸的主要方法有硝酸氧化乙二醛法、草酸电解还原法以及臭氧氧化马来酸酐法等。硝酸氧化乙二醛法的条件温和、工艺简单成熟、设备投资费用少,目前被国内大部分厂家所采用。由于乙醛酸极易被硝酸进一步氧化生成乙二酸,因此反应的关键在于精确控制反应进程、防止过度氧化。相对于传统的反应釜而言,微反应器具有较好的传质和传热效果,能够实现对反应过程参数(温度、压力、流量、停留时间)的精确控制。使整个生产过程的生产效率得到提高,通过自控实现整体设备的稳定运行,大大增加了反应过程的安全性。
1 微反应器中乙醛酸的制备
实验装置如图1所示,硝酸和乙二醛按照摩尔比0.85:1分别通过泵1、泵2泵入微反应器,采用分段控温的方式进行实验,在t1温度下,乙二醛与硝酸在反应器中混合并反应,在t2温度下混合液在微通道中继续反应;然后反应在10~15℃下于微通道外接一段盘管中淬灭,反应液经过背压阀进入收集瓶中,得到产品待分析。
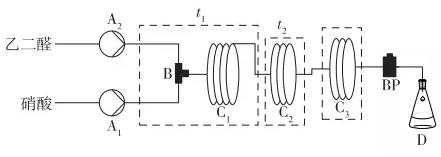
图1 微通道反应器
2 温度的影响
当硝酸(35%)与乙二醛(40%)摩尔比为0.85:1,乙二醛流速(Q1)为4.7 mL/min、硝酸流速(Q2)为5.3 mL /min。总停留时间为4min54s,其中t1段停留时间为54s,t2段停留时间为4min。背压阀压力为0.5MPa时,温度对转化率及选择性的影响如表所示。图2为保持t2温度为40℃,考察t1温度的影响因素。图3为控制t1温度为80℃,考察t2温度的影响因素。
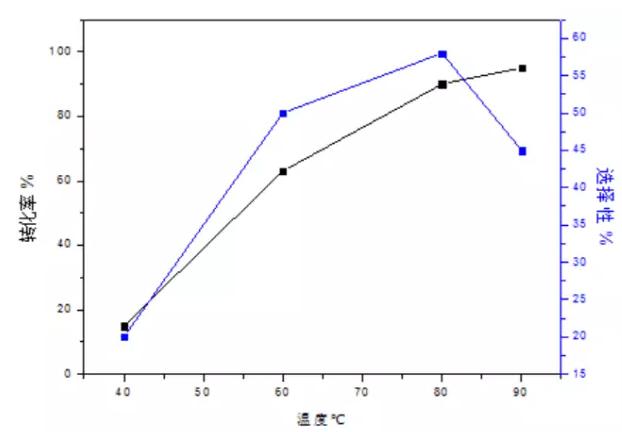
图2 t1温度的影响因素
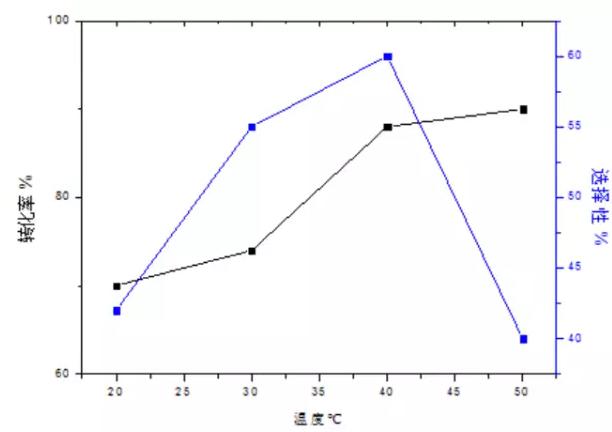
图3 t2温度的影响因素
由图2、图3可以得出:当t1由40℃升高到90℃时,转化率由15%升高到95%,选择性由20%升高到58%,然后又降低到45%。原因可能是温度较低时,反应速率较慢仅有少量的乙二醛被硝酸氧化,随着温度的升高,反应逐渐被引发,因此转化率和选择性都升高; 但当温度由80℃继续升高,此时生成物会继续被氧化成草酸,因此选择性降低; 当t1 = 40℃时,温度较低,乙二醛被氧化引发较困难,且乙二醛易聚合,易形成较多的自聚物,因此选择性较低。当t2由20℃升高到50℃时,转化率由70%升高到90%,选择性由42%升高到60%,然后降低到40%。分析其原因可能是反应在t1温度下已经被引发,在t2温度下,乙二醛继续参与反应,因此转化率升高; 当t2由20℃升高到40℃时,由于聚合的乙二醛在t1温度下预热一段时间,已有部分开始解聚,处于t2温度下时,虽然温度较低,但是解聚反应不能立即停止此时解聚速率大于聚合速率,因此选择性逐渐增加,当t2由40℃继续升高时,促进了乙醛酸向草酸转化,故选择性降低。因此,在下一步实验中选择t1 = 80℃、t2 = 40℃。
3 压力的影响
在硝酸氧化乙二醛的过程中会有NO产生,有研究表明体系中NO的存在对乙二醛的氧化起促进作用,即NO与硝酸反应生成亚硝酸,然后亚硝酸与乙二醛反应生成乙醛酸。在有气体起促进作用的条件下,压力对反应也起了很大的促进作用。图4表示压力对反应的转化率和选择性的影响。此图表明,当压力升高时,反应的转化率与选择性均升高,这是由于在压力较小时,体系内的混合效果差,且体系不稳定。但是当压力持续增大时生成的NO与乙醛酸分离困难,当乙醛酸与硝酸接触混合时,生成的亚硝酸直接与乙醛酸反应,使得体系内与乙二醛接触的亚硝酸的含量减少,反应速率降低,故转化率与选择性同时降低。故压力1.0MPa为反应过程中的最佳选择。
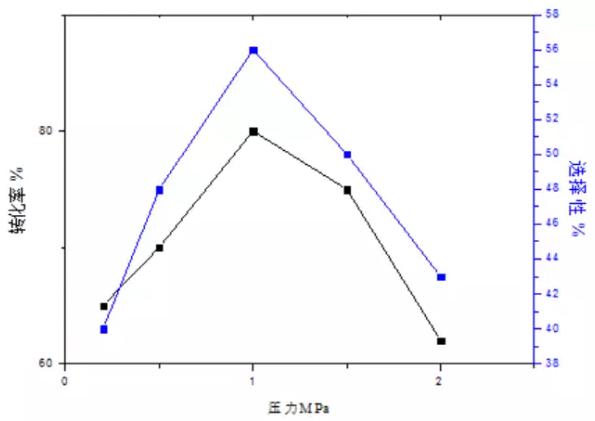
图4 压力对反应过程的影响
4 加料方式的影响
此工艺的难点是要防止乙二醛的过氧化,因此除了温度、压力等传统反应器必须考虑的影响因素之外,还可以考虑采用分段进料的方式。如果初始进料量过少,则反应速率较低,反应时间延长; 若初始进料量过多,则乙醛酸容易被氧化,易导致选择性降低。在使用微通道反应器实现连续化的过程中,首先将硝酸与乙二醛的摩尔比由0.3:1在第一块反应片进料,接着在第三片反应片补加0.12mol的硝酸,通过此种方式是反应的转化率与选择性均达到70%以上,而且,相对于传统的釜式工艺相比降低了整个反应过程中硝酸的用量,减少了后处理压力。
5 结论
此类硝酸氧化的反应有大量热放出,而且在反应过程中很容易有过氧化的产物产生。由于微通道反应器具有很好的传至与传热效果,能够实验对反应条件的精确控制。因此在传统反应釜中温度不易控制或者由于返混的原因导致反应的选择性低的反应类型可通过微通道反应器中分段控温以及分段进料的方式来达到较好的实验结果。相对于传统的釜式反应,微通道反应器的优势主要体现于:
①实验对反应条件(温度、压力、流量)的精确控制。
②双面换热,对于放热量大的化学反应类型有较大的优势。
③连续流反应器,没有返混,增加反应的选择性。
④占地面积小,能够实验化工厂实验室化。

